医疗器械第三方物流企业是医疗器械经营流通环节的重要参与者,但是我国对它的监管还没有形成完善的制度。医疗器械GSP规范已经对第三方物流企业的管理作出了相关规定,为了落实《医疗器械经营管理办法》以及GSP规范的要求,对第三方物流配送模式作出探索实乃当务之急。北京市先行先试,已经迈出了步伐。2015年4月11日,北京药监局发文决定启动第三方物流试点评估工作,下面是通知全文:
2015年4月11日北京市食品药品监督管理局发布了《关于开展医疗器械第三方物流试点评估及相关工作的通知》,“通知”内容如下:
各区县局,各直属分局,各医疗器械经营企业:
2013年9月,我局启动了医疗器械流通环节第三方物流试点工作,在医疗器械经营企业中对骨(齿)科植入类、心脏(内、外科)植入类、血液处理及人工器官类、一次性使用无菌耗材类、体外诊断试剂类等高风险医疗器械产品的委托物流进行试点。
试点工作开展以来,医疗器械经营企业积极响应,踊跃申报。经现场考察和综合评价,全市共有10家企业获得试点资格并相继开展工作。试点情况表明,医疗器械第三方物流模式对促进医疗器械经营环节贮存运输的规范化、集约化管理,满足行业发展需要,具有积极意义。
同时,对提升医疗器械流通过程产品安全保障水平、提升流通环节监管效能有着积极作用。2014年10月施行的《医疗器械经营监督管理办法》,已将医疗器械经营企业为其他医疗器械生产经营企业提供贮存、配送服务正式确定为一种经营模式,纳入医疗器械流通环节日常监管范畴。
为全面总结试点经验,建立和完善医疗器械经营企业第三方物流业务的监管机制和制度,促进医疗器械流通环节水平提升,经研究决定对我市医疗器械第三方物流试点工作进行全面评估和总结。现就评估工作有关事宜通知如下。
一、评估内容和工作要求
(一)试点企业业务开展情况评估。依据《医疗器械经营监督管理办法》、《北京市医疗器械经营监督管理办法实施细则》(以下简称《实施细则》)、《医疗器械经营质量管理规范》(以下简称《规范》)要求,研究设定此次评估指标(见附件1),对各试点企业物流综合能力、质量管理体系建立运行情况、现代物流技术手段运用情况、产品质量安全保障能力情况进行专业评价,形成试点企业综合物流能力评估报告,并在此基础上形成医疗器械经营企业为其他医疗器械生产经营企业提供贮存、配送服务现场检查技术指南。
(二)全市医疗器械流通环节第三方物流发展趋势评估。根据全市高风险医疗器械经营企业经营规模、仓储运输能力和市场总量情况,对全市高风险医疗器械经营企业发展趋势进行预测,形成医疗器械经营环节物流发展规划报告,为今后医疗器械第三方物流企业的市场准入、日常监管机制和制度的建立及完善提供决策参考。
二、评估流程和工作安排
(一)试点企业评估资料要求。即日起至2015年4月30日,试点企业(见附件2)将试点工作总结、《医疗器械第三方物流试点综合信息评估表》及相关资料(见附件3)交至企业注册地区县局或直属分局,试点工作总结应当包括试点期间接受委托贮存、配送业务开展情况、物流质量管理体系运行情况、存在的问题以及对第三方物流模式的建议。
(二)评估工作程序。2015年4月起,由市局药械市场处组织综合评估组对10家试点企业的物流能力实施评估。综合评估组由高校专家、市局药械市场处、企业注册地及库房所在地区县局或直属分局监管人员共同组成;评估过程分为材料确认、现场核实、综合评估三个阶段,现场评估时间在材料确认之后,现场评估组不少于4人。评估完成后形成企业物流综合管理能力评估报告,并对企业经营管理与《实施细则》和《规范》的符合性做出结论。
(三)试点完成后的备案工作。试点企业通过评估后,视同符合《规范》及《实施细则》附件7《医疗器械经营企业为其他医疗器械生产经营企业提供贮存、配送服务技术要求》,按照《实施细则》的有关规定予以备案,可按正式备案的业务范围提供医疗器械贮存、配送服务业务。拟增加为其他企业提供贮存、配送服务经营模式的试点企业,在提交评估资料时可同时提交备案申请及相关资料(见附件4)。
2015年12月31日前未提交备案申请的试点企业,以及经综合评估不符合《实施细则》和《规范》相关要求的企业,自2016年1月1日起终止试点工作,已经取得的试点批复自动失效,已经承接的委托业务应妥善处理。
三、其他
(一)评估工作开始后,不再增加医疗器械第三方物流试点单位,试点企业以外的其他医疗器械经营企业拟提供医疗器械贮存、配送服务业务的,可以按照《实施细则》有关要求,在2015年7月15日后向注册地区县局或直属分局提交备案申请及相关资料(见附件4),市局将根据企业申请备案的范围,按照现场检查技术指南组织实施现场验收,符合现场检查技术指南的予以备案,不符合的不予备案。
(二)已经备案提供医疗器械贮存、配送服务业务的企业,应当与委托方签订书面质量协议,明确双方权利义务及贮存、配送过程的质量责任;医疗器械贮存、配送服务业务发生变化的,应当及时向企业注册地所在区县局或直属分局报告。
(三)各区县局和直属分局要结合区情合理安排工作和人员,积极参与医疗器械第三方物流试点评估工作,着手培养本局从事相关业务企业监督检查的专业人员,为适应行业发展储备技术力量。
特此通知
附件1:医疗器械第三方物流综合能力评估指标框架
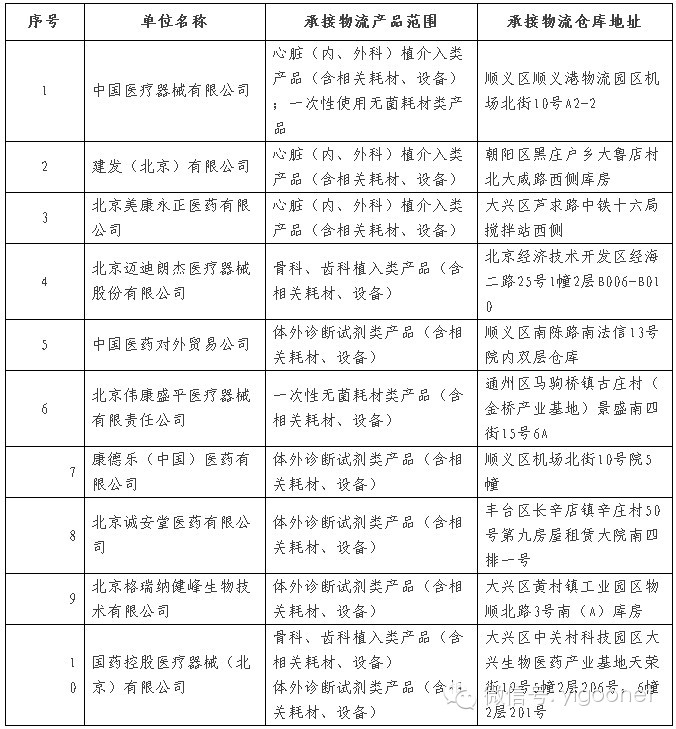
附件2:医疗器械第三方物流试点企业名单
附件3:医疗器械第三方物流综合评估相关资料
附件4:为其他医疗器械生产经营企业提供贮存配送服务备案资料
附件1.医疗器械第三方物流综合能力评估指标框架
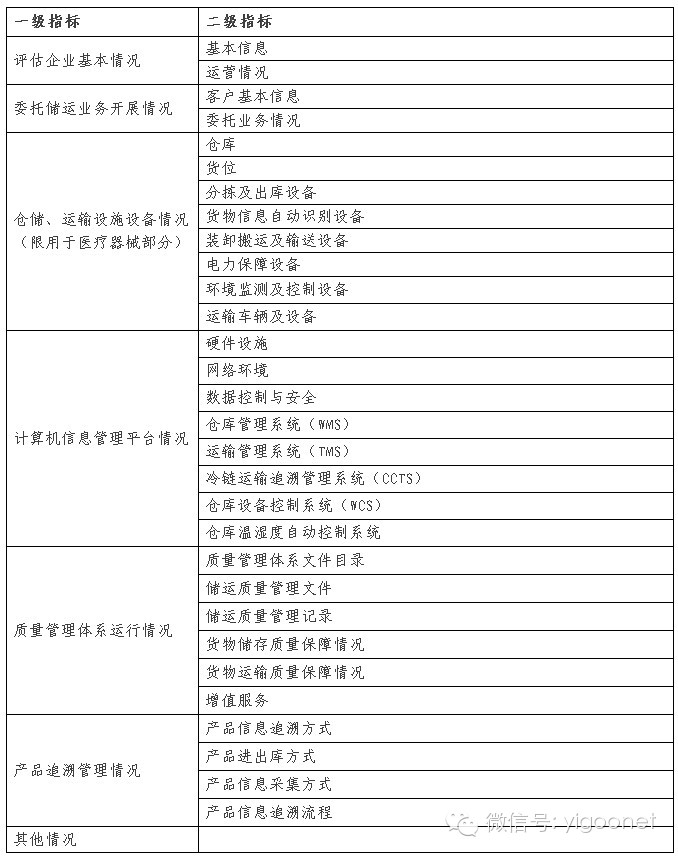
附件2.医疗器械第三方物流试点企业名单
附件3.医疗器械第三方物流综合评估相关资料
1. 《医疗器械第三方物流综合信息评估表》(含电子版);
2. 营业执照复印件;
3. 医疗器械经营许可证复印件;
4. ISO13485认证证书复印件、ISO14001认证证书复印件;
5. 2014年纳税年报表;
6. 与委托单位的委托合同复印件;
7. 库房使用权证明材料复印件,库房平面图(标注库房类型及货位);
8. 运输车辆行驶证复印件,车辆租赁协议复印件;
9. 计算机系统软件功能介绍;
10. 2014年度企业内审报告;
11. 评估表电子版直接发给被评估企业联系人,按要求将所列项目填写完成后,将电子版及上述材料一同交至区县局或直属分局
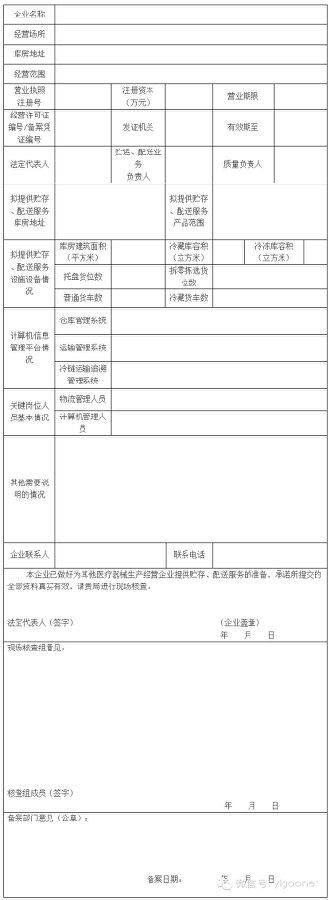
附件4:为其他医疗器械生产经营企业提供贮存配送服务备案资料
1. 《为其他医疗器械生产经营企业提供贮存、配送服务备案表》(可从市局官网下载填报);
2. 企业《医疗器械经营许可证》、《第二类医疗器械经营备案凭证》复印件;
3. 企业从事物流管理、计算机信息管理平台管理、质量管理的主要人员学历、职称证明复印件;
4. 企业承接医疗器械贮存、配送服务能力介绍(包括库房平面图及功能分区,贮存运输设施设备目录,质量管理体系文件目录)
5. 企业计算机信息管理平台功能介绍;
6. 企业拟提供贮存、配送服务业务流程和技术方案;
7. 委托双方质量保障协议,委托贮存、配送医疗器械产品查验标准;
8. 申报资料要求:《备案表》一式三份,企业法定代表人签字,加盖企业公章;编号2~7的材料一式两份,分别装订成册,加盖骑缝章(公章)
为其他医疗器械生产经营企业提供贮存、配送服务备案表
备案编号:(由区县局或直属分局填写)
(来源:北京市CFDA)


 京公网安备 11011502003804号
京公网安备 11011502003804号


